Stamceltherapie voor dummies
13 november 2009 · 10:30| Leestijd:7 min![]()
Update: 15 november 2024 · 08:13
Het is geen onderwerp waar de gemiddelde Nederlander dagelijks over praat. ‘Stamceltherapie, dat is toch iets ingewikkelds om ziektes te genezen, en ligt toch ethisch erg gevoelig?’ ‘Visie’ geeft een lesje stamceltherapie – in Jip en Janneke-taal.
Wie als leek zijn tanden in een taai onderwerp zet, begint met de vraag: waar praat ik over? Wat is de definitie? Over stamceltherapie zegt de Dikke van Dale vreemd genoeg (nog?) niets. Dan maar naar Wikipedia, de internetencyclopedie, al wordt daar ook niet alles duidelijk. Wikipedia beweert dat ‘het basisidee bestaat uit de transplantatie van stamcellen ter vervanging van afwezige of defecte cellen, weefsels of organen.’ Het draait dus om stamcellen, die we in eigen a-wetenschappelijke termen omschrijven als een soort oercellen. Ze vormen de basis van het menselijk lichaam en zijn door deling in staat om in een ander celtype te veranderen. Zo kan een stamcel uit een embryo een van de 220 verschillende celtypen in ons lichaam worden, zoals bijvoorbeeld een hartspiercel, rood bloedlichaampje of huidcel.
Wat kun je dan precies met zo’n oercel?
Het idee is simpel. Haal zieke of beschadigde cellen weg en plaats bewerkte, schone stamcellen terug. De schade die een hartinfarct heeft aangericht, moet je zo kunnen herstellen; alsof er niets is gebeurd. Toen in 1998 voor het eerst zo’n oercel uit een embryo werd gehaald, steeg de euforie onder wetenschappers logischerwijs tot een kookpunt. Tegenstanders wezen direct op talloze ethische bezwaren van stamceltherapie.
Wat zijn dan die bezwaren?
Zoals er grote weerstand bestaat tegen abortus en euthanasie, zo zien veel christenen in stamceltherapie een groot gevaar. “Want,” roepen zij, “wie geeft wetenschappers het recht om levende embryo’s te doden om stamcellen te isoleren? Daarmee ga je immers op de stoel van God zitten.” Het maakt volgens hen niet uit dat het meestal gaat om ‘restembryo’s’ van ivf-pogingen, die door invriezing sterk verminderd levensvatbaar zijn. Anderen vinden het vreemd dat deze sceptici vaak wél heftig protesteren tegen stamceltherapie, maar niet tegen het ingeburgerde ivf, terwijl daar deze embryo’s ‘overblijven’. Dat de ethische druk inmiddels wat van de ketel is, is te danken aan een nieuwe doorbraak – met een opmerkelijke aanleiding. Bij het zien van een embryo in een vruchtbaarheidskliniek in 1999 associeerde de Japanse wetenschapper Shinya Yamanaka dit voor het eerst met zijn eigen dochters. Zó waren hun levens ook begonnen. Tegen de New York Times zei hij: “Ik dacht: ‘We kunnen niet doorgaan met het vernietigen van embryo’s voor ons onderzoek. Er moet een andere manier zijn.’’’
Die andere manier vond hij acht jaar later, toen hij erin slaagde om een huidcel te deprogrammeren tot een multifunctionele stamcel. Een stukje huid van een patiënt heeft zo precies dezelfde eigenschappen als een stamcel uit een embryo en is nu dus – in theorie – geschikt om een ander deel in het lichaam te repareren. ‘Induced Pluripotent Stem Cell’ noemt Yamanaka zijn variant, met als roepnaam IPS. Bijkomend voordeel? Je gebruikt lichaamseigen materiaal, waardoor je geen last van afstoting hebt. De keerzijde van deze techniek is het risico op het ontstaan van enorme tumoren, wat overigens bij embryonale stamcellen niet veel anders is. Desondanks voorspelde de Amerikaanse ontdekker van menselijke embryonale stamcellen, James Thomson, dat “over een decennium het onderzoek van nu, waarbij menselijke embryo’s worden gebruikt, niet meer zal zijn dan een historische voetnoot.”
Is de ethische discussie nu voorbij?
De Nederlandse ethicus prof. dr. Henk Jochemsen (voorheen directeur van het Lindeboom Instituut) wijst het gebruik van embryonale stamcellen categorisch van de hand. Hij noemt IPS een goed voorbeeld van gezonde ethiek die tot gezonde wetenschap leidt. Toch zijn nog lang niet alle ethische vragen verdwenen. Want wat als die IPS-stamcellen (de techniek is immers nog zo pril) tegenvallen? Voor je het weet, komen alle felbevochten ethische kwesties rondom bijvoorbeeld embryo’s of klonen weer als een boemerang op ons af. Wetenschappers zonder bijvoorbeeld een christelijk mensbeeld zullen immers geen moeite hebben om terug te grijpen op het gebruik van embryo’s.
Maar ook over de techniek van IPS kun je voldoende vragen stellen. Want stel je voor dat je steeds in staat bent om defecte weefsels of organen te herstellen, ben je dan niet bezig om een soort van eeuwig leven te creëren? Ook is het al mogelijk om een cel uit een muis te ‘verbouwen’ tot spermacel. Wat als ‘we’ dit binnenkort ook kunnen met de veel complexere eicellen? Dan kun je – wederom in theorie – in een laboratorium nieuw leven scheppen. Hoezo de ethische discussie is voorbij? Want wíe krijgt de toegang tot deze technieken en welke rol krijgt of heeft het bedrijfsleven in dit gesleutel aan ons DNA? Moeten we wetenschappers op hun blauwe ogen vertrouwen, of is het vooral zeer noodzakelijk om paal en perk te stellen aan deze ontwikkeling?
Wanneer krijg je hier als individu mee te maken?
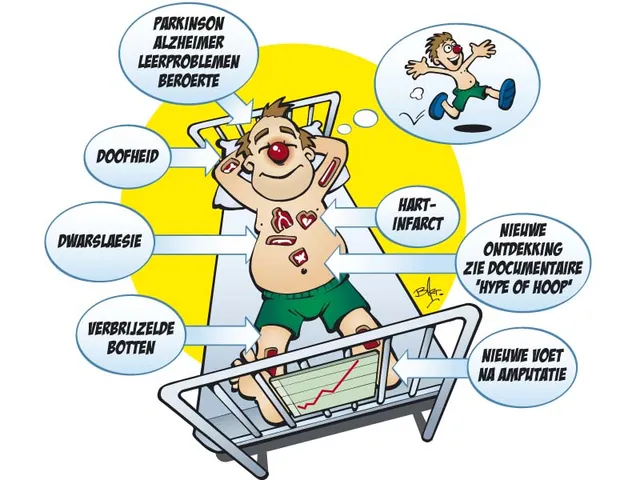
Als je geen interesse hebt in medische theorie en bovendien nog kerngezond bent, is deze ontwikkeling wellicht aan je voorbij gegaan. Maar wie te maken heeft met bijvoorbeeld diabetes, of ethische discussies op de voet volgt, zal zijn oren hebben gespitst toen allerlei veelbelovende claims begonnen rond te zingen. In 1998 stonden we aan de vooravond van een medische revolutie, zo gonsde het. De tijd leek eindelijk rijp om kapotte organen te repareren of te vervangen, en wie kan dáár nu op tegen zijn? Ziektes als diabetes, alzheimer en parkinson zouden snel tot het verleden behoren.
Hoewel de ontwikkelingen niet stilstaan, lijken tien jaar later de hooggespannen verwachtingen naar beneden bijgesteld te moeten worden. De meeste successen tref je aan op het terrein van volwassen stamcellen, waarvan de onomstreden behandeling met leukemie (beenmergtransplantatie) het bekendste voorbeeld is.
Welke regels kent Nederland?
Beperken we ons tot het gebruik van embryo’s voor stamceltherapie, dan kent ons land een beleid van ‘nee, tenzij’, zoals vastgelegd in de Embryowet. Dit betekent dat het gebruik van restembryo’s om stamcellijnen te produceren alleen is toegestaan als er geen alternatieven zijn. Die zijn er anno 2009 volop, dus is het een fabel dat er in ons land dagelijks embryo’s sneuvelen voor stamceltherapie. Per 1 januari 2007 is stamceltherapie in Nederlandse ziekenhuizen verboden, omdat er volgens het ministerie van Volksgezondheid nog te veel risico’s aan zijn verbonden. Alleen de academische centra en het Nederlands Kanker Instituut mogen de therapie als experiment toepassen. Daarnaast is het gebruik van (embryonale) stamcellen voor het klonen van mensen in de hele Europese Unie verboden.
Wat kunnen we in de toekomst verwachten?
De discussie zal blijven, de schreeuwerige droomscenario’s van allerlei stamcelcowboys ook. Google op stamcel en je vindt therapieën voor dwarslaesie, autisme en zelfs een erectiestoornis. Maar wie verwacht dat er snel een oplossing komt voor bijvoorbeeld alzheimerpatiënten of hartproblemen, komt van een koude kermis thuis. Deze oplossing is er pas als je eerst de volledige controle over individuele cellen hebt, die je vervolgens eenduidige opdrachten kunt geven. Naar die mogelijkheid gaat het grote zoeken vooralsnog uit. Tot dat moment temperen steeds meer wetenschappers de jubelstemming. De tijd zal dus moeten leren of het tumult rondom stamceltherapie zieke mensen écht hoop kan geven, of dat het toch vooral een hype is. Feit is dat stamceltherapie vanuit het laboratorium nog steeds niet is aangekomen bij het ziekenhuisbed. Wie weet, duurt dat nog wel twintig jaar.
Tekst: Maarten Nota
Beeld: Bart den Heeten
Meest gelezen
- Je weet niet dat je date: dit unieke datingprogramma wil je zien
Wil je zien
Je weet niet dat je date: dit unieke datingprogramma wil je zien
- Voorganger gaat viraal met deze uitleg van 'Home Alone': zit het evangelie verstopt in de kerstfilm?
Inspiratie
Voorganger gaat viraal met deze uitleg van 'Home Alone': zit het evangelie verstopt in de kerstfilm?
- Ontdek de beste boekentips voor lange winteravonden
Boekentips
Ontdek de beste boekentips voor lange winteravonden
Lees ook
- De kerk saai? Hoe een jaar vol feesten je helpt bij je geloof: het geheim van het kerkelijk jaar in 5 vragen
Theologisch Tussendoortje
De kerk saai? Hoe een jaar vol feesten je helpt bij je geloof: het geheim van het kerkelijk jaar in 5 vragen
- Een winterslaper, sneeuwzoeker of naar-het-zuiden-vlieger: welk winterdier schuilt in jou?
Doe de test!
Een winterslaper, sneeuwzoeker of naar-het-zuiden-vlieger: welk winterdier schuilt in jou?
- ‘Henk Binnendijk heeft mij bij Jezus gebracht’ – hoe een duidelijke boodschap Johan radicaal veranderde
Inspiratie
‘Henk Binnendijk heeft mij bij Jezus gebracht’ – hoe een duidelijke boodschap Johan radicaal veranderde





